做“雙抗”賽道吃螃蟹者:康方生物-B(9926.HK)赴港IPO
新冠疫情席捲全球,在金融黑天鵝頻發之際,作為傳統防禦板塊的醫藥板塊,正在受到資本界的額外關注。具有廣譜性的腫瘤治療新藥PD-(L)1正在迅速普及全球癌症治療市場,被稱為“下一代抗體”的雙特異性抗體的藥企也在加快研發進程。
雖然雙抗的技術更加先進,但生產與研發技術門檻相比起單抗更高,因此能夠擁有雙抗技術的公司少之又少,走在賽道前列的康方生物-B(9926.HK),近日也通過港交所聆訊,開始招股。根據公司披露,此次招股期為4月14日至4月17日,每股發售價14.88-16.18港元,每手1000股,入場費16343.05港元,摩根士丹利與摩根大通為其聯席保薦人,預計4月24日上市。
在研產品管線亮眼
未盈利生物科技類公司的資質好不好,主要還是看他的研發能力強不強,首先來看康方生物的在研產品管線,主要特點是產品管線較多(相較於其他未盈利生物科技類公司),產品技術含量高,並且呈現多元化。
目前,公司共計擁有20多個藥物開發項目,其中12個抗體處於臨牀階段,6個雙特異性抗體(兩個處於臨牀階段)以及4個抗體獲得FDA的IND批准。自2017年以來,公司已經就創新候選藥物啟動22項臨牀試驗。
公司的研發管線涵蓋了PD-1、CD47、CD73、IL-12/IL-23、IL-17、IL-4R等與腫瘤免疫治療和自身免疫相關的熱門靶點。此外,產品的組合形式也是比較多樣,有單克隆抗體,有單抗與其他藥物聯合的combo,還有一系列全球首創處在臨牀開發階段的雙特異性抗體。
圖表一:在研產品管線

數據來源:招股説明書,格隆彙整理
AK104:潛在First-in-Class雙特異性抗體,臨牀II期
PD-(L)1單抗藥物的上市,為治療腫瘤疾病提供了新的治療方式,憑藉着其具有廣譜性的特點,成為近年創新藥企研發的熱門靶向候選藥物。
然而,在治療範圍廣之下,單一使用PD-(L)1抗體藥物的效果並沒有想象中那麼好。根據Frost&Sullivan數據統計顯示,在各種獲批以及正在試驗的實體瘤適應症的所有癌症患者中,相對較小比例的患者對PD-(L)1抗體藥物顯示出有意義的緩釋,緩釋率普遍較低。
圖表二:PD-(L)1抗體藥物單一療法用於治療實體瘤的緩釋率
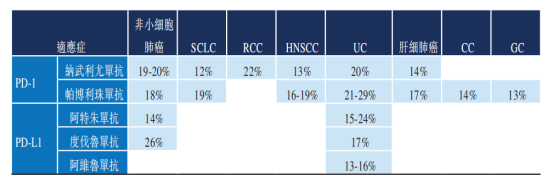
數據來源:Frost&Sullivan,格隆彙整理
那麼是否有辦法可以提高藥物的緩釋率?目前臨牀上比較有效的方式是採用聯合治療的方式,也就是多種治療方式同時使用,可以有效改善治療效果。例如,利用納武單抗以及伊匹單抗同時靶向PD-1以及CTLA-4的聯合療法已被批准,患者的總緩釋率大幅改善,治療效果優於單一療法。
在解決緩釋率低的問題之後,還存在一個問題,那就是藥物的毒性。雖然納武單抗與伊匹單抗聯合用藥的治療效果比單一用藥好,但是不良事件的比率也在上升,這也使得不少科學家將目標轉向雙特異性抗體(BsAb),這個被《自然﹒綜述:藥物發現》雜誌稱為“下一代抗體”的新技術。
雙特異性抗體,是一種可以同時結合兩種特異性表位或目的蛋白的人工工程化抗體,具有同時結合兩個不同表位的能力,可以起到一些特殊的生物學功能。
AK104是康方生物自主研發的全球首個進入臨牀試驗的PD-1/CTLA-4的雙特異性抗體,目標是在保留聯合療法的療效的同時,也能夠建立優於聯合療法的安全性。
從AK104的作用機理來看,作為一個新型的四價雙特異性抗體,可以通過優先雙重阻斷腫瘤微環境中的兩種經過驗證的免疫檢查點分子,來保留PD-1與CTLA-4單克隆抗體聯合療法
中觀察到的療效,同時降低活化T細胞攻擊外周位點健康組織的傾向。
圖表三:AK105作用機理

數據來源:招股説明書,格隆彙整理
獨特的設計,也使得AK104存在以下優勢:
(1)親和力強。公司通過四價結構設計令AK104對有PD-1和CTLA-4共表達特點的腫瘤微環境而非正常外周血具有更高的親和力;
(2)療效好。根據公司此前披露的臨牀數據顯示,在之前接受過大量治療無效的癌症患者的試驗中觀察到良好的療效;
(3)毒性弱。相較於PD-1與CTLA-4的聯合療法,AK104的不良反應率較低,毒性較弱。
(4)專業的臨牀開發計劃。除了產品設計優勢外,憑藉康方生物的專業研發團隊以及清晰的臨牀試驗開發計劃,相信會讓AK104的各種適應症獲快速批准,迎合廣闊的市場機遇。
從臨牀進度上來看,AK104已在澳洲啟動Ia/Ib期試驗,並在中國啟動五項Ib/II期及II期試驗,包括兩項Ib/II期籃子試驗,涵蓋多種腫瘤類型。2019年3月,公司已獲得FDA針對評估AK104的IND批准。2020年1月,公司就一項於美國對2L/3L子宮頸癌患者進行的計劃註冊試驗整體研究設計獲得FDA書面同意,並有可能通過快速審批通道向FDA提交子宮頸癌NDA申請,預計將於2021年下半年在中國提交AK104治療子宮頸癌的首次NDA。
從競爭情況上來看,AK104處於同業領先的情況。目前,FDA僅獲批了2種雙特異性抗體,其中只有一種是腫瘤免疫療法。而在臨牀研究中,根據Frost&Sullivan數據統計顯示,截止2019年9月30日,全球共計擁有90多種雙特異性抗體正在進行臨牀試驗,其中18種雙特異性抗體至少針對一個免疫檢查點,例如PD-(L)1。康方生物的AK104,是全球首個進入臨牀試驗的同時擁有PD-1與CTLA-4靶點的雙特異性藥物,也是目前國內市場上基於PD-(L)1的雙特異性抗體的在研產品中,位列第一梯隊的藥物。
AK105:潛在Best-in-Class單克隆抗體,臨牀III期
AK105是由康方生物自主研發的重組人源化抗PD-1 單克隆抗體。2019年6月17日,中山康方生物醫藥有限公司( "康方生物 ")宣佈,康方生物與中國生物製藥有限公司("中國生物製藥")旗下的正大天晴藥業集團股份有限公司( "正大天晴")簽訂合營合同,成立合營公司,共同開發康方生物的PD-1抗體 AK105 項目("AK105 項目")並全力推動該藥物的註冊上市及商業化。
相較於市面上已經銷售的PD-1抗體,作為具有差異化的潛在同類最佳的PD-1單抗penpulimab(AK105)具有以下優勢:
(1) 結構設計獨特。通過差異化結構設計(i)去除Fc受體介導效用功能從而基本去除ADCC效應,增加抗腫瘤活性及(ii)導致解離速率較慢,受體佔位較好;
(2) 臨牀試驗數據優秀。根據公司此前披露的臨牀試驗中可以觀察到,AK105擁有強大療效數據及良好安全性;
(3) 強強聯合進行開發研究。作為中國生物製藥唯一可用於開發的基於PD-1抗體單一療法或聯合療法(如與正大天晴的安羅替尼聯用)的產品,同時針對一系列關鍵適應症正在臨牀開發後期;
(4) 銷售能力強。中國生物獨家銷售權,公司將利用中國生物製藥約 12,000名專業人員的強大銷售團隊為AK105商業化保駕護航。
從臨牀進度上來看,目前AK105項目正在中國和澳洲啟動7項臨牀研究,其中在中國進行專注於安羅替尼聯合試驗的5項註冊試驗。根據目前的臨牀開發狀況,預計將於2020年中在中國提交penpulimab(AK105)治療複發性或難治性經典型霍奇金淋巴瘤的首次NDA。
強大的技術與平台鑄就“護城河”
2000年前,全球獲批的單克隆抗體藥物屈指可數,限制其開發的最大的瓶頸就是生產工藝和規模化生產。伴隨着抗體生產CMC的成熟發展,單克隆抗體藥物如同雨後春筍,基於同一個靶點開發的單抗更是鱗次櫛比。
而康方生物深耕的雙抗賽道,正如同早期的單克隆抗體藥物一般,研發門檻高,生產門檻更高。但是此時的康方生物已經擁有完善的技術平台與一體化生產能力作為其領先優勢的“護城河”。
在技術平台上,康方擁有獨特的Tetrabody雙功能抗體技術,成為現有屈指可數的獲得生產和臨牀驗證的雙抗平台之一。由Tetrabody技術開發出的AK104和AK112雙抗都是全球首創,全球最先進入臨牀的雙抗新藥。
在生產上,如何能夠在工業上進行大規模、穩定地生產成為後續開發雙抗的難點所在。目前,公司擁有的ACE平台具有符合NMPA、FDA及EMA監管的國際GMP標準的強大內部生產能力。2016年,公司建立了華南地區第一家採用具有中央控制系統的GE FlexFactory技術的生物製劑生產設施,從而可以最短生產週期及較低經營成本來快速擴大生產規模或在各種候選藥物之間切換生產。
此外,公司正在廣州一幅56,573平方米的土地上興建另外一個新生產設施,估計總共可容納40,000升的生物反應器,其中包括土地一期施工中配備的最多八個2,000升生物反應器,總容量達16,000升,預期於2020 年底前完成安裝及投入營運。
獲多家機構看好,現金充裕
那麼對於康方生物的產品和技術,用腳投票的資本市場是如何看待的?從此前公佈的融資情況來看,公司的獲得同業以及著名PE/VC機構看好。
其中,投資機構主要包括與港股生物醫藥第一藍籌股中國生物製藥公司(01177.HK),以及善於投資長線及國際專業醫療投資基金例如清池資本、奧博資本、杏澤資本、交銀國際、建信資本等機構。
那麼在融資之後,面對正在處於臨牀後期燒錢的康方,他的現金狀況如何?
翻看招股説明書可以看到,公司的現金流還算是充裕,手有餘糧,心中不慌。公司在2019年底,現金及現金等價物擁有11.86億元,到了今年的2月29日為止,也還是擁有8.67億元的現金及現金等價物,能夠繼續支撐公司進行臨牀的研發與生產。
圖表四:公司現金狀況
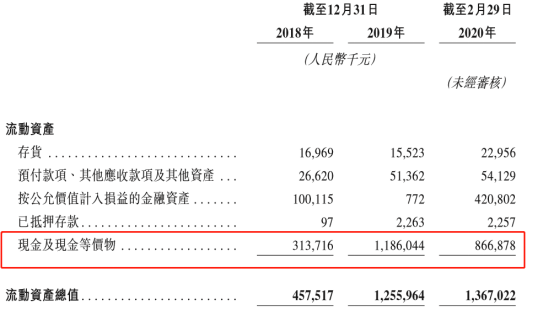
數據來源:招股説明書,格隆彙整理
小結
在康方生物上市之前,我們已經看到有一些老牌的藥企以及Biotech類公司開始佈局雙抗市場,但從佈局到臨牀研發,這意味着已經過去了4年以上的前期臨牀研究時光。換言之,相比起如今準備開始佈局的企業,康方實際上在這個領域已經着實領先了很多。而到了大家都能夠開始研發的階段,康方生物又憑藉早先佈局的生產與技術平台,能夠早進行批量化生產,成為這個賽道上“吃螃蟹”之人。
而這,僅僅只是公司研發的一小部分。在這個追求創新的時代,license-in極其普遍,但是康方所有項目全部自我研發,建立了中國最完善的In-House抗體新藥開發和產業化體系,也開發出中國最豐富、最多元化的新藥產品管線之一。早在2015年,公司更是憑藉強大的研發實力和商業開拓能力,成為了中國第一家向全球製藥巨頭默沙東授權自主研發抗體許可的中國生物科技公司。從自主研發再到license-out,康方生物走的遠比想象中的多,走得遠。



