君實生物(688180.SH)半年報:營收同比增長267.77%、處於商業化階段的在研產品共2項
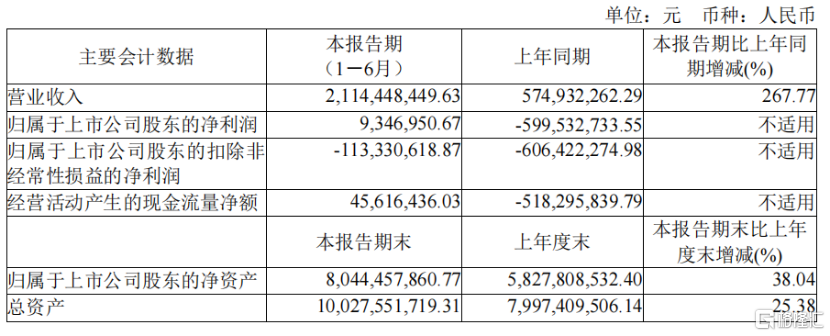
格隆匯8月30日丨君實生物(688180.SH)發佈2021年半年度報告,實現營業收入21.14億元,同比增長267.77%;歸屬於上市公司股東的淨利潤0.09億元,歸屬於上市公司股東的扣除非經常性損益的淨利潤-1.13億元,扣除非經常性損益後淨利潤仍爲負數主要由於公司對在研項目研發投入的持續加大以及對商業化產品特瑞普利單抗的推廣力度的加大。
報告期內,公司研發費用爲9.47億元,同比增長33.62%。研發費用增長主要由於公司在報告期內不斷豐富和拓展在研產品管線,快速推進現有臨牀項目的開展,持續探索藥物在臨牀階段的聯合治療方案所致。報告期內,公司銷售費用爲4.23億元,與上年同期相比增長85.22%。隨着特瑞普利單抗的準入醫院數量及覆蓋藥房數量大幅度增加,公司商業化團隊一線銷售人員擴充以及商業化推廣力度加大導致銷售費用相應增長。
公司是一家創新驅動型生物製藥公司,具備完整的從創新藥物的發現和開發、在全球範圍內的臨牀研究、大規模生產到商業化的全產業鏈能力。
公司旨在通過源頭創新來開發first-in-class(同類首創)或best-in-class(同類最優)的藥物,通過卓越的創新藥物發現能力、強大的生物技術研發能力、大規模生產技術,已成功開發出極具市場潛力的在研藥品組合,多項產品具有裏程碑意義:核心產品之一特瑞普利單抗是國內首個獲得國家藥監局批準上市的國產抗PD-1 單克隆抗體;昂戈瑞西單抗和UBP1213 是中國本土公司首次獲得國家藥監局IND 批準的抗PCSK9 單克隆抗體和抗BLyS 單克隆抗體;TAB004/JS004 是公司自主研發、全球首創的抗BTLA 單克隆抗體,已獲得FDA 和NMPA 的臨牀試驗批準,目前正在中美兩地開展臨牀試驗;公司還與國內科研機構攜手抗疫,共同開發新冠病毒中和抗體JS016,用本土創新爲中國和世界疾病預防控制貢獻力量,目前已獲得美國FDA 緊急使用授權。公司的創新研發領域已經從單抗藥物類型擴展至包括小分子藥物、多肽類藥物、抗體藥物偶聯物(ADCs)、雙特異性或多特異性抗體藥物、核酸類藥物等更多類型的藥物研發以及癌症、自身免疫性疾病的下一代創新療法探索。
公司的核心團隊成員均來自於行業知名機構、跨國企業或監管機構,具有良好的教育背景和豐富的研發、註冊、質量管理、生產、銷售與公司治理經驗。依託優秀的人才儲備和持續的資金投入,公司已建立全球一體化的研發流程,並於美國的舊金山、馬裏蘭以及國內的上海及蘇州都設有研發中心。公司自主開發並建立了涵蓋蛋白藥物從早期研發到產業化的整個生命週期的完整技術體系,該體系包括多個技術平臺:(1)抗體篩選及功能測定的自動化高效篩選平臺、(2)人體膜受體蛋白組庫和高通量篩選平臺、(3)抗體人源化及構建平臺、(4)高產穩定表達細胞株篩選構建平臺、(5)CHO 細胞發酵工藝開發平臺、(6)抗體純化工藝及製劑工藝開發與配方優化平臺、(7)抗體質量研究、控制及保證平臺、(8)抗體偶聯藥研發平臺、(9)siRNA 藥物研發平臺。
公司擁有2個生產基地。蘇州吳江生產基地已獲GMP認證,擁有4500L發酵能力,其中3000L發酵能力可用於公司產品的商業化生產和臨牀試驗用藥的生產,報告期內新增1500L發酵能力,用於支持阿達木單抗的原液生產及其他在研藥物的臨牀試驗用藥生產。上海臨港生產基地按照CGMP標準建設,其中一期項目產能30000L,已於2019 年底投入試生產,目前正在進行特瑞普利單抗的技術轉移工作,並在報告期內支持了JS016項目的臨牀試驗樣品在全球臨牀試驗的供藥和原液供應。由於規模效應,臨港生產基地產能的擴充亦將爲公司帶來更具競爭力的生產成本,並通過更多臨牀試驗加速推出新藥物。根據目前在研產品管線的研發進度,公司計劃進一步擴展我們的生產設施,以提供可與公司日益增長及漸趨成熟的在研藥物相匹配的充足產能,並支持公司的業務在未來的持續擴張。 公司高度重視知識產權保護,設置專利部門負責境內外專利的申報與維護工作。
截至報告期末,公司擁有86項已授權專利,其中66項爲境內專利,20項爲境外專利。專利覆蓋新藥蛋白結構、製備工藝、用途、製劑配方等,爲公司產品提供充分的和長生命週期的專利保護。
截至公告披露日,公司在研產品管線覆蓋五大治療領域,包括惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統類疾病以及感染類疾病。其中,處於商業化階段的在研產品共2項(特瑞普利單抗以及埃特司韋單抗),處於新藥上市申請階段在研產品1項(阿達木單抗),除上述產品外另有16項在研產品處於臨牀試驗階段(其中PARP 抑制劑、昂戈瑞西單抗以及貝伐珠單抗處於三期臨牀試驗階段),25項在研產品處在臨牀前開發階段。